-
Karbonskābes
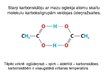
Karbonskābju molekulas uzbūve.
Karbonskābes molekulā ūdeņraža atlikums ir saistīts ar karboksilgrupu.
Karboksilgrupā novērojama arī mijiedarbība starp hidroksilgrupas nedalītajiem elektronu pāriem un karboksilgrupas elektronu sistēmu.
No tā elektronu blīvums no ūdeņraža atoma ir ievērojami atvirzīts un ūdeņraža atoms ir daudz kustīgāks nekā spirtu molekulās.
Tātad šis protons no karbonskābes spēj atšķelties. Pierādās arī karbonskābju īpašību skābo raksturu. Šajās reakcijās pārtrūkst saite
-O / H hidrosilgrupā :
RCOOH RCOO- +H+
RCOOH + H20 RCOO- + H2O+
Karbonskābju fizikālās īpašības
Karbonskābju fizikālās īpašības atkarīgas no oglekļa atomu skaita molekulā:
a) C1–C3 – šķidrumi ar kodīgu smaržu;
b) C4– C8 – smarža kļūst arvien nepatīkamāka;
c) C15 – C18 – kristāliskas vielas ar vāju stearīna smaržu.
Kušanas temperatūra karbonskābēm pieaug līdz ar oglekļa atomu skaitu molekulā, taču šis pieaugums nav vienmērīgs.
Karbonskābēm, kurām oglekļa atomu skaits molekulā ir pāra skaitlis, kušanas temperatūra ir augstāka nekā aiz tām sekojošām karbonskābēm, kam oglekļa atomu skaits ir par vienu lielāks.
Šāda savdabīga pāra un nepāra karbonskābju atšķirība parādās ne tikai kušanas temperatūrās, bet arī to ķīmiskajās un bioloģiskajās īpašībās.
Saites pārtrūkšana.
Karbonskābju molekulās reakcijas notiek arī pie karboksilgrupas oglekļa atoma, atšķeļot –OH grupu. Veidojās karbonskābju funkcionālie atvasinājumi – ēteri, amīdi un citi.
Nozīmīga skābju īpašība ir veidot ēterus, reakcijā ar spirtiem.
Šādas reakcijas sauc par esterificēšanas reakcijām.…
Zināms, ka etānskābe no metānskābes un pentānskābe no butānskābes atšķiras ar –CH2- grupu, tātad tās ir homologi un pieder pie vienvērtīgo piesātināto karbonskābju homologu rindas. Šīs homologu rindas vispārīgā formula ir R-COOH, kur R ir piesātināto ogļūdeņražu atlikums. Svarīgas ir arī citas karbonskābes ar lielāku oglekļa atomu skaitu molekulā. Šīs karbonskābes iegūtas no taukiem, tāpēc tās sauc arī par taukskābēm.